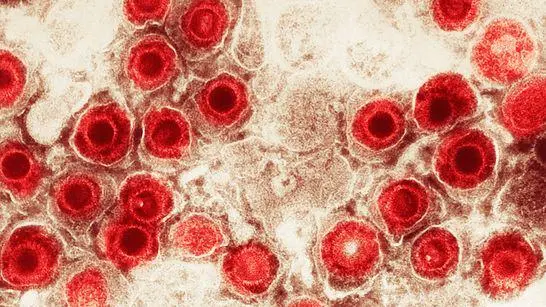
Vírus comuns podem aumentar o risco de Alzheimer?
Durante décadas, a pesquisadora Ruth Itzhaki diz que seu trabalho foi ignorado, tratado com hostilidade e chegou a ser classificado por outros especialistas como “ruim”, “lixo” e “ridículo”.
Ela foi uma das primeiras neurocientistas a suspeitar — e demonstrar — que vírus comuns podem ter um papel importante no desenvolvimento da doença de Alzheimer.
“Nós não conseguíamos que nossos artigos científicos fossem aceitos e publicados em jornais acadêmicos. Com isso, não tínhamos acesso ao financiamento para novas pesquisas. E, sem dinheiro suficiente, era difícil seguir com os estudos”, lembra Itzhaki, que é professora emérita da Divisão de Neurociências da Universidade de Manchester, no Reino Unido.
“Foi extremamente difícil e lidamos com a falta de dinheiro o tempo todo”, complementa a pesquisadora, que atualmente é professora visitante do Instituto de Envelhecimento Populacional da Universidade de Oxford.
Itzhaki acredita que, se o trabalho dela e de outros investigadores tivesse recebido a devida atenção e incentivo anos atrás, seria possível ter hoje uma compreensão muito mais ampla sobre as causas da demência e as melhores formas de combatê-la.
Mas o tempo das vacas magras para esse ramo da ciência parece ter chegado ao fim.
Nos últimos três ou quatro anos, a publicação de novas pesquisas deu um novo ânimo ao campo que busca pistas na virologia para entender as neurociências — e motivou o início dos primeiros ensaios clínicos com vacinas e antivirais como potenciais ferramentas de prevenção do Alzheimer.
Conheça a seguir as evidências disponíveis sobre o papel de agentes infecciosos no apagamento das memórias e nas dificuldades de raciocínio.
Vírus escondidos e os mistérios do Alzheimer
Para saber como o conhecimento nessa área tem evoluído, é preciso antes entender dois conceitos básicos e bem estabelecidos.
O primeiro deles é que alguns vírus têm a capacidade de ficar “escondidos” por muito tempo, praticamente por toda a vida, em alguns reservatórios do organismo.
É o caso do herpes simples do tipo 1 (que afeta a boca), do tipo dois (que atinge a região genital) e do varicela-zoster (causador da catapora).
Após a infecção inicial, esses patógenos permanecem no corpo e podem ser reativados de tempos em tempos.
No caso do herpes simples, em momentos de baixa imunidade, surgem aquelas bolhas e feridas típicas na pele.
Já o varicela pode gerar um quadro chamado herpes zoster, marcado por erupções cutâneas bem dolorosas num trecho do corpo, como parte do rosto, do abdômen ou das costelas.
O segundo conceito tem a ver com o Alzheimer em si. Em meados dos anos 1990, a chamada “cascata amiloide” ganhou força como a principal explicação para esse tipo de demência.
Essa linha de raciocínio sustenta que tudo começa com uma inflamação no cérebro. Com o tempo, há o acúmulo de uma proteína chamada beta-amiloide do lado de fora dos neurônios.
Depois, a TAU — um outro tipo de proteína — começa a ser estocada em grandes quantidades no interior das células nervosas.
Esse processo dificulta a conexão entre diferentes partes da cabeça e causa a morte dos neurônios — o que se traduz na progressão da perda de memórias, da dificuldade de raciocínio e dos demais sintomas do Alzheimer.
“Mas ainda não sabemos o que faz essas duas proteínas se depositarem no cérebro”, acrescenta a neurologista Roberta Diehl Rodriguez, pesquisadora da Faculdade de Medicina da Universidade de São Paulo (FMUSP).
Seriam vírus os gatilhos da demência?
Foi nessa busca por respostas para o fator que iniciaria a cascata amiloide que alguns pesquisadores começaram a suspeitar dos agentes infecciosos.
Entre as décadas de 1980 e 90, a professora Itzhaki fez os primeiros trabalhos que detectaram o material genético do herpes simples tipo 1 — um vírus extremamente comum, que afeta ao redor de 70% da população — no cérebro humano.
“Nós já sabíamos que esse vírus pode causar uma encefalite [uma inflamação do sistema nervoso], um quadro bem raro, mas muito grave”, descreve ela.
“Começamos a especular, então, se a reativação do herpes ao longo da vida não poderia desencadear uma série de eventos que culminariam em danos às células do sistema nervoso, que eventualmente levassem à morte delas.”
Esses trabalhos pioneiros foram os primeiros a encontrar agentes infecciosos no cérebro — até então, havia praticamente um consenso de que o Sistema Nervoso Central era uma região praticamente protegida da ação dos vírus.
Algo que chamou a atenção dos pesquisadores à época era que o herpes marcava presença tanto na cabeça de pessoas diagnosticadas que morreram com Alzheimer quanto naquelas que não apresentaram a doença durante a vida.
Na avaliação deles, deveriam existir alguns outros fatores, como a genética, que pudessem explicar por que alguns indivíduos infectados desenvolviam a demência e outros não.
Nos anos 1990, o time liderado por Itzhaki fez outra descoberta relevante: eles observaram em cobaias de laboratório que o herpes simples costuma se concentrar em regiões do cérebro que apresentam uma grande deposição da beta-amiloide.
Isso gerou uma nova teoria: será que essa proteína é produzida pelo sistema nervoso como uma defesa, com o objetivo de “capturar” o vírus e inativá-lo?
Sabe-se que essas moléculas têm um aspecto grudento — e poderiam supostamente “agarrar” o patógeno para dificultar a sua replicação antes que uma resposta imune mais elaborada fosse iniciada.
A grande questão aqui é que o herpes tem aquela característica de ficar “escondido” e se reativar de tempos em tempos ao longo da vida.
No cérebro, isso causaria uma inflamação repetida e geraria a fabricação da beta-amiloide com uma certa frequência.
Com o passar do tempo, o que antes funcionava como um mecanismo de proteção se transforma num problema: como descreve a cascata amiloide, o acúmulo da proteína faz mal aos próprios neurônios e eventualmente provoca a morte deles.
Vale lembrar aqui que essa ainda é uma teoria, que precisa ser comprovada em diversas pesquisas e aceita como um consenso entre especialistas da área.
O papel das vacinas
Recentemente, uma nova leva de trabalhos encontrou mais evidências do possível papel de agentes infecciosos no desenvolvimento do Alzheimer.
Um deles foi publicado no início de abril na revista Nature — e avaliou o papel da vacinação nesse contexto.
Em suma, pesquisadores da Universidade Stanford, nos Estados Unidos, identificaram uma oportunidade a partir de uma decisão de saúde pública que aconteceu no País de Gales.
Em 2013, o governo local começou um esforço de vacinação contra o herpes zoster e estabeleceu um limite bem claro.
Pessoas que haviam nascido entre os dia 2 de setembro de 1933 e 1 de setembro de 1934 poderiam tomar o imunizante. Já aquelas que nasceram antes ou depois dessa data estavam fora da campanha.
“Nós tínhamos uma situação muito parecida a de um estudo clínico: dois grupos muito similares em diversos aspectos, que poderiam ser comparados, cuja diferença era a elegibilidade para tomar a vacina contra herpes zóster”, resume o pesquisador Pascal Geldsetzer, professor assistente de Medicina, Epidemiologia e Saúde Populacional da Universidade Stanford.
Os resultados da análise mostraram que, entre as pessoas que receberam o imunizante, a probabilidade de um diagnóstico de demência nos sete anos seguintes era 3,5% menor — uma taxa considerada significativa.
“Pela primeira vez, temos evidências que provavelmente revelam uma relação de causa e efeito entre a vacinação contra o herpes zóster e a prevenção da demência. Nosso estudo mostrou que esse efeito protetor é grande e supera as ferramentas farmacológicas disponíveis hoje para tratar a demência”, comemora o pesquisador.
Mas o que explica esse efeito? Geldsetzer aponta dois possíveis caminhos.
“O primeiro tem a ver especificamente com o vírus varicela [cuja reativação causa o herpes zoster]. Um crescente corpo de evidências sugere que vírus que atuam preferencialmente no sistema nervoso e permanecem ali durante boa parte da vida podem estar implicados no desenvolvimento da demência”, responde ele.
Nesse sentido, a vacinação contra o herpes zoster bloqueia a reativação do vírus — e, com isso, em teoria, impediria que o agente infeccioso servisse de gatilho para a inflamação e a produção de beta-amiloide.
“O segundo mecanismo é potencialmente independente do vírus varicela. Temos cada vez mais provas de que as vacinas produzem efeitos no sistema imunológico que são muito mais amplos do que apenas estimular a produção de anticorpos contra um patógeno específico”, acrescenta o pesquisador.
“E esse efeito imunológico mais amplo, por sua vez, pode trazer benefícios contra outras doenças”, complementa ele.
O autor do trabalho recém-publicado quer agora fazer um teste clínico convencional — que envolve recrutar voluntários, dividi-los em grupos e avaliar os efeitos da vacinação contra a demência ao longo do tempo — e corre para encontrar financiamento para custear esse trabalho.
“Se a vacina contra o herpes zóster realmente for capaz de prevenir ou atrasar o aparecimento da demência, essa seria uma enorme descoberta”, diz ele.
Fonte: BBC Brasil